|
|
 |
|
|
|
|
水の硬度とは、水に溶けているCa2+およびMg2+ の量をCaCO3(ppm)に換算したものである。硬度には、全硬度(Ca2+とMg2+)、Ca硬度、およびMg硬度がある。
EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価〜4価の金属イオンと、そのイオンの価数に関係なく1:1で結合し、安定なキレート化合物を生成する。この反応を利用した金属イオンの定量法をキレート滴定法という。(キレートとはカニのはさみの意味)
なお、EDTAは水にほとんど溶けないため、キレート滴定では水に溶けやすいEDTA・2Naを用いる。
EDTAと金属イオンの反応例(6座配位)【反応例拡大】
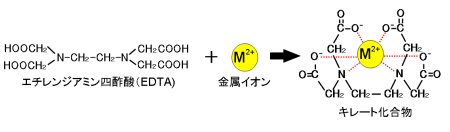
この滴定では、pHによりEDTAと金属イオンを選択的に反応させることができる。
全硬度の測定は、試料水のpHを約10に調整した後,BT指示薬を加えて、EDTA溶液で滴定して求める。BT指示薬はpH10付近では青色を呈するが、Ca2+、Mg2+などの金属イオンを含む溶液中に加えるとキレート化合物を生成し、赤紫色を呈する。次に、この溶液にEDTA標準溶液を滴下すると,EDTAの方がBT指示薬よりも、Ca2+、Mg2+とキレート化合物を作りやすいため、Ca2+、Mg2+はEDTAと結合して無色のキレート化合物となり、反応終了とともに溶液の色は遊離したBT指示薬により青色となる。
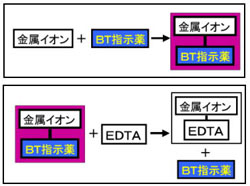
【キレート滴定の原理図拡大】
pH12〜13において、Mg2+は安定な水酸化物となってEDTAと反応しなくなるので、このpH領域で作用するNN指示薬を用いて Ca2+ のみを定量することができる。
試料水中に含まれる、Fe2+、Cu2+などもEDTAと反応するが、隠ぺい剤としてNa2Sを加えておくと、これらのイオンは安定な硫化物となってEDTAと反応しなくなる。
|
|
| Copyright (C) 2005 岐阜県教育委員会. All Rights Reserved. |
|
|
|